|
�Q�@�C�I���� �y�C�I���ƃC�I���̐����z �C�I�� ���q���ŊO�k�̓d�q����o������C�ŊO�k�ɓd�q����荞�肵�čŊO�k������ȓd�q�z�u�i�k��8�j�ɂȂ�����Ԃ��C�I���ł����B���q�͐��̓d�ׂ����k
�z�q �l�ƕ��̓d�ׂ����k �d�q �l�̐����������̂œd�C�I�ɒ����ł��邪�C���q���d�q����o���邱�Ƃɂ���Ăł����C�I���͗z�q�����d�q�̕������Ȃ��Ȃ�C�S�̂Ő��̓d�ׂ����̂Łk
�z�C�I�� �l�Ƃ����B����C���q���d�q���Ƃ邱�Ƃɂ���Ăł����C�I���́C�z�q�����d�q�̕��������Ȃ�C�S�̂ŕ��̓d�ׂ����̂Łk
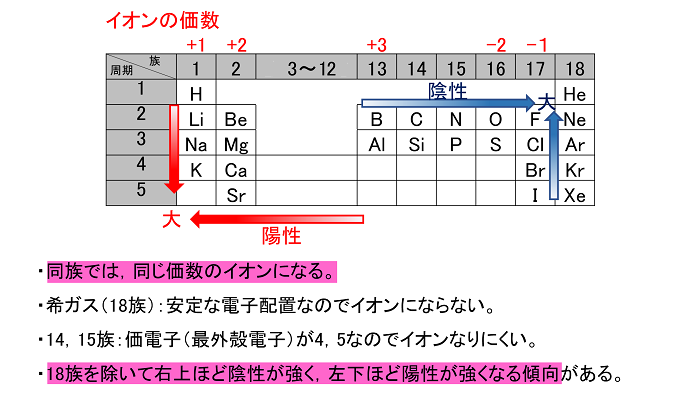
�A�C�I�� �l�Ƃ����B�C�I����Na�{��Cl�|�Ƃ��������w���ŕ\����C������k �C�I���� �l�Ƃ����B �z�C�I���̐��� �@�ŊO�k�̓d�q�i���d�q�j�����k�@1�`3�@�l�̌��q�́C�ŊO�k�̓d�q����o���Ĉ���ȓd�q�z�u�ƂȂ�B�d�q����o�������������̓d�ׂ������B���̂́u�`�C�I���v�Ƃ����B���������C�I���̓d�q�z�u�́C���q�ԍ��̍ł��߂���K�X���f�Ɠ����ɂȂ��B ��j11Na�i�z�q11�C�d�q11 �j�ˁk�@Na�{�@�l�i�z�q11�C�d�q10�j�i�g���E���C�I�� |
|
 |
|
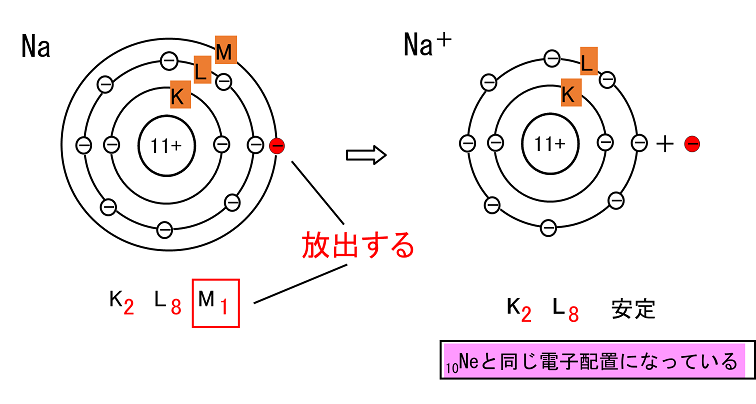
| Na���d�q��1���o�����̂ŁC�S�̂Ł{1�i�z�q11�C�d�q10�j�ɂȂ����̂�Na�{�Ǝ����B 20Ca�i�z�q20�C�d�q20�j�ˁ@�k�@Ca2�{�@�l�i�z�q20�C�d�q18�j�J���V�E���C�I�� 13Al�i�z�q13�C�d�q13�j���@�k�@Al3�{�@�l�i�z�q13�C10�j�A���~�j�E���C�I�� |
|
 |
|
|
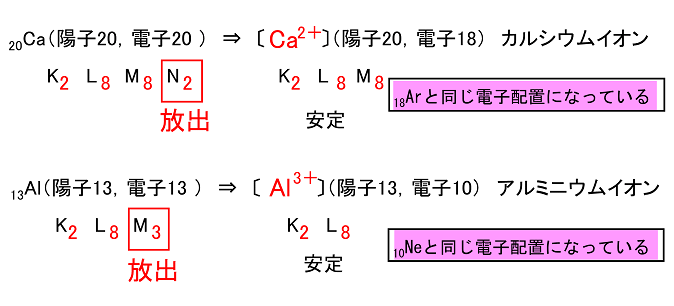
Ca�͓d�q��2�CAl�͓d�q3���o�����̂ŁC���ꂼ��S�̂�2�{�C3�{�ƂȂ�CCa2�{�CAl3�{�Ǝ����B ��� �@Mg�CK�����ꂼ��C�I���ɂȂ����Ƃ��̓d�q�z�u�C�C�I�����C�C�I���̖��̂��L���B �@12Mg�@K2L8M2�@�ˁ@K2L8�@Mg2�{�@�}�O�l�V�E���C�I�� �@19K�@K2L8M8N1
�ˁ@K2L8M8�@K�{�@�J���E���C�I�� �A�C�I���̐��� �ŊO�k�̓d�q�i���d�q�j�����k�@6�`7�@�l�̌��q�́C�ŊO�k�ɑ�����d�q����荞��ň���ȓd�q�z�u�ƂȂ�B�d�q����荞���������̓d�ׂ������B���̂́u�`�����C�I���v�Ƃ����B�C�I���̓d�q�z�u�́C���q�ԍ��̍ł��߂���K�X���f�Ɠ����ɂȂ��B ��j17Cl�i�z�q17�C�d�q17�j�ˁ@�k�@Cl�|�@�l�i�z�q17�C�d�q18�j�������C�I�� 8O�i�z�q8�C�d�q8�j�ˁ@�k�@O2�|�@�l�i�z�q8�C�d�q10�j�_�����C�I�� |
|
 |
|
| Cl�͓d�q��1�CO�͓d�q��2������̂ŁC���ꂼ��S�̂Ł[1�C�[2�ƂȂ�CCl�|�CO2�\�Ǝ����B
�@F�CS�����ꂼ��C�I���ɂȂ����Ƃ��̓d�q�z�u�C�C�I�����C�C�I���̖��̂��L���B �@9F�@K2L7�@�ˁ@K2L8�@F�|�@�t�b�����C�I�� �@16S�@K2L8M6�@�ˁ@K2L8M8�@S2�|�������C�I��
|
|
|
��ȒP���q�C�I���i1�̌��q����ł��Ă���C�I���j �@�P���q�C���́C�d�q�z�u�ōl��������͍̂l���ăC�I���ɂ���B����ȊO�͊o����B |
|
 |
|
|
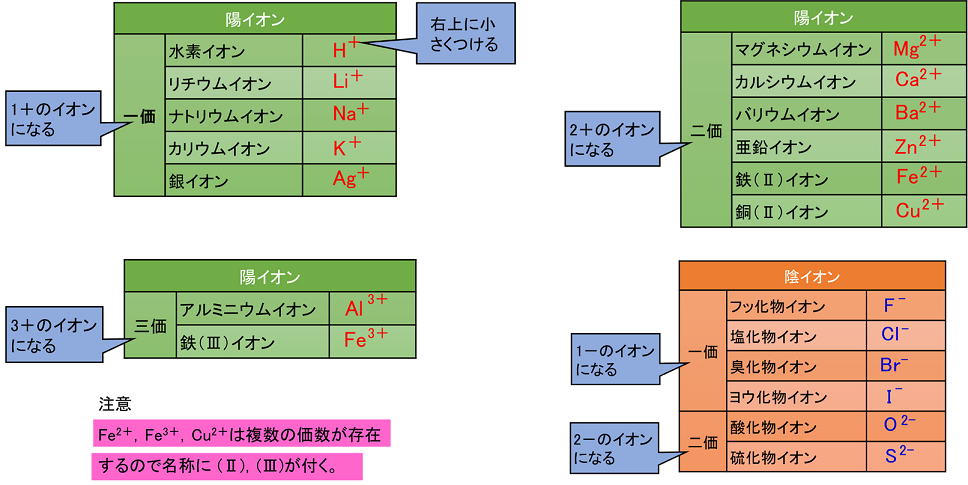
�{�C2�{�C3�{�̗z�C�I�������ꂼ��ꉿ�C�C�O���̗z�C�I���Ƃ����C�|�C2�|�̃C�I���C�I�������ꂼ��ꉿ�C�̉A�C�I���Ƃ����B
|
|
|
��� ���̒����琳�������̂����ׂđI�ׁB �@�@���q�̑傫���́C���q�j�̑傫���ɂقړ������B �A�@���q�̒��S�ɂ́C�z�q���܂ތ��q�j������̂ŁC���q�͐��ɑѓd���Ă���B �B�@�ł��O���̓d�q�k��L�ł��錴�q�ǂ����ł́C���w�I���������Ă���B �C�@���q�̎��ʂ́C���q�Ɋ܂܂��z�q�Ɠd�q���ʂ̘a�ɂقړ������B �D�@���q�ԍ��������ŁC���ʐ����قȂ錴�q�ǂ������݂��ɓ��ʑ̂Ƃ����B �@�D ��� ���̌��q������ȃC�I���ɂȂ����Ƃ��̃C�I�����Ɩ��̂������B�܂��C���̃C�I���Ɠ����d�q�z�u�����M�K�X�̖��̂���B (1)�@Li�@�@(2)�@O�@�@(3)�@Al�@�@(4)�@Cl�@�@(5)�@Ca (1)�@Li�{�@K2�@���`�E���C�I���@He�@�@(2)�@O2�|�@K2L8�@�_�����C�I���@Ne �@(3)�@Al3�{�@K2L8�@�A���~�j�E���C�I���@Ne�@�@(4)�@Cl�|�@K2L8M8�@�������C�I���@Ar �@(5)�@Ca2�{�@K2L8M8�@�J���V�E���C�I���@Ar
(1)�@Cu2�{�̓d�q�̐���27�ł���B���̌��q�ԍ��͂������B (2)�@Ne��Ar�̂����C���q���a���傫���̂͂ǂ��炩�B�܂��CAl3�{��O2�|�̂����C�C�I�����a���傫���̂͂ǂ��炩�B �@ (1)�@29 �@�@�@Cu2�{�@�ˁ@Cu���d�q��2���o���Ăł����C�I�� �@�@�@�@�@�@�@�@�@Cu��27�{2��29�̓d�q�����B�z�q�����d�q���Ȃ̂ŁC �@�@�@�@�@�@�@�@�@���q�ԍ�29 �@(2)�@Ar�C �@�@�@�@10Ne�iK2L8�j��18Ar�iK2L8M8�j�Ȃ̂ŁCAr�̕����ŊO�k������傫�� O2�| �@�@�@�@13Al3�{�iK2L8�j�͗z�q13�i13�{�j�Ɠd�q10�i10�|�j�C8O2�|�iK2L8�j�͗z�q8�i8�{�j�Ɠd�q10�i10�|�j�Ȃ̂ŁCAl3�{�̕����C�d�q�i10�|�j����苭�������t���Ă���i�{13�̕����{8��������L�k�������t���Ă���j�̂�Al3�{�̕����C�I�����a���������Ȃ�B
��� |
|
 |
|
|
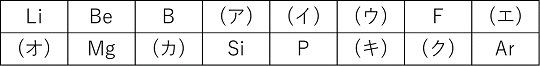
(1)�@(�A) �` (�N) �ɓ��Ă͂܂錳�f�L�����L���B (2)�@Li�̓d�q�z�u��K2L1�Ǝ������BP�̓d�q�z�u�������B (3)�@Mg������ȃC�I���ɂȂ����Ƃ��̓d�q�z�u�������B (4)�@�z�����ł��������f�����f�L���ŕ\���B (5)�@�ꉿ�̉A�C�I���ɂȂ�₷�����̂�2�I�сC���f�L���ŋL���B (1)�@(�A)�@C�@�@(�C)�@N�@�@(�E)�@O�@�@(�G)�@Ne�@�@(�I)�@Na�@�@(�J)�@Al�@(�L)�@S�@�@(�N)�@Cl (2)�@�@�@�@�A�@K2L8M5 (3)�@K2L8�@�@(4)�@Na�i�����\�̍����j�@(5)�@F�CCl �����q�C�I�� �����̌��q����Ȃ�C�I���𑽌��q�C�I���Ƃ����B���Ɏ��������q�C�I���͂悭�o�Ă���̂Ŋo����K�v������B |
|
 |
|
|
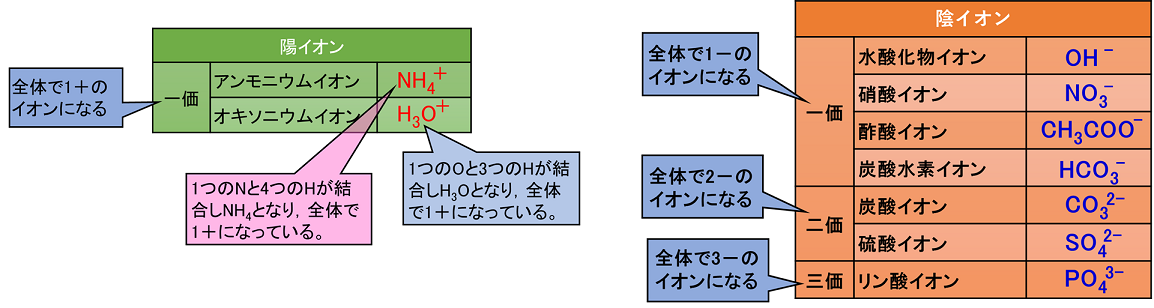
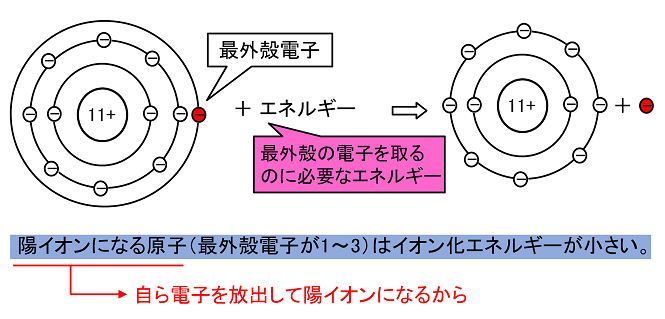
����@���̃C�I��1�����d�q�̑�������B (1)�@OH�|�@�@(2)�@NH4+�@�@(3)�@SO42�| (1)�@8O 1�C1H 1�C�S�̂�1�|�@�ˁ@8�{1�{1��10�� (2)�@7N 1�C1H 4�C�S�̂�1�{�@�ˁ@7�{1�~4�|1��10�� (3)�@16S 1�C8O 4�C�S�̂�2�|�@�ˁ@16�{8�~4�{�Q��50�� �y�C�I�����G�l���M�[�Ɠd�q�e�a�́z �C�I�����G�l���M�[ �@���q�̍ŊO�k����d�q1����苎����1���̗z�C�I���ɂ���̂ɕK�v�ȃG�l���M�[���C�I�����G�l���M�[�Ƃ����B�C�I�����G�l���M�[���k�@�����@�l�����q�قǗz�C�I���ɂȂ�₷���B�i�z�C�I���ɂȂ錴�q�i�ŊO�k�d�q��1�`3�j������d�q����o���ėz�C�I���ɂȂ邩���C�I�����G�l���M�[���������B�j�@�@�@�@�@�@�@�@�@ ��j11Na �� Na�{ �{ �d�q |
|
 |
|
|
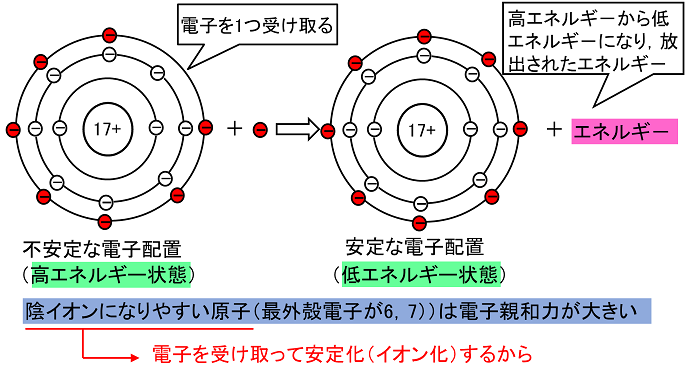
�d�q�e�a�� �@���q���ŊO�k�ɓd�q1�������1���̉A�C�I���ɂȂ�Ƃ��ɕ��o�����G�l���M�[��d�q�e�a�͂Ƃ����B�d�q�e�a�͂��k�@�傫�@�l�����q�قljA�C�I���ɂȂ�₷���B�i�A�C�I���ɂȂ�₷�����q�i�ŊO�k�d�q��6�C7�j���d�q������Ĉ��艻�i�C�I�����j���邩���d�q�e�a�͂��傫���j ��j17Cl�@�{�@�d�q�@���@Cl�| |
|
 |
|